

Wer in der Schweiz Spenderblut erhält, kann mit einer Sicherheit von eins zu einer Million davon ausgehen, dass dieses nicht HIV-infiziert ist. Serologische Tests ermöglichen dieses ausgezeichnete Resultat. Am Nationalen Zentrum für Retroviren ist man jetzt daran, mittels neuer molekularer Diagnostiktechnologie ein Verfahren zum Nachweis von HIV- und Hepatitis-B-Viren zu entwickeln, das noch mehr Sicherheit für ganze «Plasmapools» bringen soll.
Von Stefan Bosbach und Jörg Schüpbach
Die Entdeckung des Blutkreislaufs im Jahre 1628 durch den Oxforder Anatomen Wiliam Harvey öffnete den Weg für erstmalige Tier-Mensch-Bluttransfusionen. Besonders Schafe, Kälber und Hunde wurden damals in Frankreich und England als Blutspender geschätzt – frühe Vorläufer der bis vor einigen Jahren auch bei uns noch häufig praktizierten Frischzelltherapie und der Xeno-transplantation.
 |
Abbildung
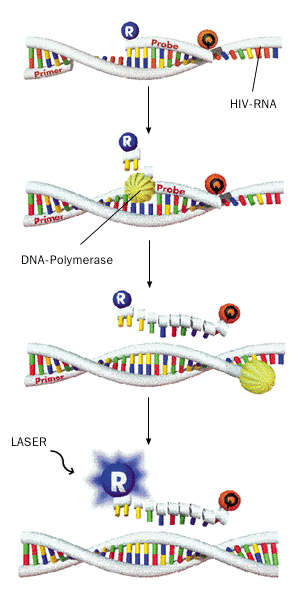
1 Nachweis von HIV-1-RNA mittels TaqMan-Technologie Die zuvor mit dem Roboter angereicherte HIV-RNA wird durch Zugabe einer Reversen Transcriptase in eine einzelsträngige komplementäre HIV-DNA umgeschrieben. Ein kurzes Stück davon wird anschliessend mittels PCR vermehrt. Dabei wird ausgehend von «Primern», welche an die Enden der zu amplifizierenden HIV-Sequenz angelagert werden, in einem zyklischen Vermehrungsverfahren jeweils ein zu einem vorbestehenden DNA-Strang komplementärer DNA-Strang enzymatisch synthetisiert. Aus einem einzelnen DNA-Stück werden so zwei zueinander komplementäre, durch Basenpaarung verbundene Stücke. Durch Erhitzung werden sie voneinander getrennt, worauf an beide Einzelstränge im nächsten Zyklus wiederum Primer angelagert werden. Aus diesem zweiten Zyklus entstehen 4, dann 8, 16, 32 usw. Stränge (exponentielle Vermehrung – in 50 Zyklen können so mehr als eine Milliarde Kopien synthetisiert werden). Im Gegensatz zu herkömmlichen PCR-Methoden wird bei der TaqMan-Technologie zwischen die beiden «Primer» zusätzlich eine ebenfalls sequenzspezifische Reportersonde gelegt, die am einen Ende eine Fluoreszenzmarkierung (R) trägt. Im intakten Reportersondenmolekül ist die Emission von Fluoreszenzlicht allerdings durch einen sogenannten «Quencher» (Q), der am anderen Ende der Sonde liegt, verunmöglicht. Wenn die von einem Primer ausgehende DNA-Synthese durch das Enzym «DNA-Polymerase» aber die Reportersonde erreicht, wird diese durch eine weitere Aktivität des Enzyms in ihre Einzelbausteine zerlegt, wodurch die Inaktivierung der Fluoreszenzgruppe durch den Quencher aufgehoben wird (der Quencher muss, um wirksam zu sein, auf demselben Molekül wie die Fluoreszenzgruppe liegen). Bei Anregung durch Laserlicht wird in der Folge ein Fluoreszenzsignal emittiert, welches durch einen Detektor gemessen werden kann. Noch während der Amplifikation erfolgt alle 6 Sekunden eine solche Messung, so dass bereits in dieser Phase eine präzise Quantifizierung des Produkts erfolgen kann. Ein weiterer Vorteil des TaqMan-Systems ist zudem, dass die Synthese und Messung in geschlossenen Reaktionsgefässen erfolgt. Die riesigen Mengen amplifizierter HIV-DNA können so nicht zur Verunreinigung von HIV-negativen Proben und falsch-positiven Resultaten (sogenanntem Carry-over) führen. |
Zu Beginn des 18. Jahrhunderts gelang dem englischen Arzt James Blundel die erste Bluttransfusion von Mensch zu Mensch. Die Mortalität lag noch bei fünfzig Prozent, da das Blut in unsterilen Behältern gesammelt wurde und die 1902 entdeckte Landsteinersche ABO-Blutgruppenunverträglichkeit noch unbekannt war. Ende des 19. Jahrhunderts erlaubten die technischen Hilfsmittel den Chirurgen eine direkte Transfusion von Vene zu Vene. Im Ersten Weltkrieg wurde entdeckt, dass Blut mit Natrium-Citrat konserviert werden kann, und in den Sechzigerjahren wurde durch die Einführung des sterilen Kunststoffbeutels die Sterilität stark verbessert. Ist damit damit das Produkt Blut aber wirklich sicher geworden?
Obwohl die durchschnittliche Lebenserwartung der Bluterkranken durch Behandlung
mit Blutgerinnungsfaktoren verdoppelt wurde, forderte der anschliessende «Blut-Boom»
in den Jahren 1969 bis 1979 einen hohen Tribut. Durch Zunahme der Drogensucht
nahmen in dieser Periode Infektionen mit Hepatitisviren stark zu.
Spenderauswahlkriterien, die aus heutiger Sicht als fahrlässig erscheinen
müssen, die noch relativ unempfindlichen Labortests zum Nachweis von Infektionserregern
sowie die noch ungenügend wirksamen Plasma-Inaktivierungsmethoden trugen
dazu bei, dass damals weltweit Zehntausende von Blutern und TransfusionsempfängerInnen
an Hepatitis erkrankten und viele daran starben.
Zu Beginn der Achtzigerjahre kam dann noch das Aids-Virus dazu: Obwohl kontaminiertes Blut schon damals nur für einen kleinen Teil der Aids-Erkrankungen verantwortlich war, starben weltweit Tausende von EmpfängerInnen von Blut und Blutprodukten an der Immunschwäche.
HIV-Screening im Blutspendewesen
Die Entdeckung, Identifizierung und Charakterisierung des HIV in den Jahren 1983/84 schuf die Grundlage für das HIV-Screening im Blutspendewesen. Prinzipiell kann die Diagnostik von Infektionserregern entweder durch den Nachweis des Erregers selbst oder der Reaktion des Immunsystems des Infizierten auf diesen Erreger, also den Nachweis erregerspezifischer Antikörper, erfolgen.
Der Vorteil der zweiten Methode liegt darin, dass solche Antikörper nach einer kurzen «Anlaufszeit», dem sogenannten «diagnostischen Fenster», während der ganzen Dauer der Infektion und noch lange darüber hinaus im Blut nachweisbar sind. Tests zum Nachweis von Antikörpern gegen HIV, Hepatitis B- und C-Viren (HBV, HCV) und andere Erreger sind daher das Rückgrat des Blutspenderscreenings.
Im Verbund mit weiteren Tests, der Entfernung der potentiell infizierten weissen Blutzellen, der Auferlegung einer Quarantänefrist auf die stabileren Blutprodukte und der Spenderbefragung, in welcher ein Risikoverhalten rechtlich verbindlich deklariert werden muss, haben diese serologischen Tests zu einer ausserordentlich hohen Sicherheit von Blut und Blutprodukten geführt. Die Wahrscheinlichkeit, dass in der Schweiz HIV mit der Transfusion eines Erythrozyten- oder Thrombozytenkonzentrates übertragen wird, beträgt etwa eins zu einer Million.
Problem Frühphase
Die einzige Lücke besteht noch in der Frühphase der Infektion. In dieser breitet sich das Virus im ganzen Körper aus. Da es auf ein noch unvorbereitetes «naives» Immunsystem trifft, werden in allen Geweben und im Blut sehr hohe Viruskonzentrationen erreicht. Dies bedeutet, dass Blut gerade dann, wenn die Antikörpertests noch versagen, besonders infektiös sein kann.
In dieser Situation kann nur ein direkter Nachweis des Virus selbst beziehungsweise seiner Bestandteile helfen. In Frage kommen Tests für bestimmte Virus- eiweisse (Antigene) und insbesondere auch molekulare Amplifikationsverfahren zum Nachweis der in Viruspartikeln oder infizierten Zellen vorhandenen viralen Erbsubstanz (je nach Virus ist dies DNA oder RNA).
Diese letzteren, auf Nukleinsäure-Amplifikations-Technologie (NAT) beruhenden Verfahren gelten derzeit als die empfindlichsten. Sie haben aber den Nachteil, dass die technischen Voraussetzungen für ein automatisiertes Massenscreening noch nicht geschaffen sind. Ins Gewicht fällt auch der noch hohe Preis. Auch mit den NAT-Verfahren kann das diagnostische Fenster nicht völlig geschlossen werden, es wird immer noch ein Zeitfenster bestehen bleiben, in welchem das Blut bereits infektiös ist, das Virus auch mit NAT aber noch nicht entdeckt werden kann. Man rechnet damit, dass die heute noch verbleibenden Übertragungsfälle mittels NAT nochmals um ein Drittel reduziert werden können.
In dieser Situation kann durch die Testung von Plasmapools mit besonders empfindlichen NAT-Verfahren ein Optimum an Effizienz erzielt werden. Durch die Testung eines Pools, der aus hundert Einzelspenden besteht, kann der Testaufwand hundertfach reduziert werden, so dass er technisch und finanziell tragbar wird.
Neues Testverfahren
Da das Nationale Zentrum für Retroviren (NZR) der Universität Zürich schon vor einigen Jahren in einer Pionierleistung ein hochsensitives Verfahren zum Nachweis von HIV-DNA aus grossen Probenvolumina, die so genannte «Mega-PCR», entwickelt hatte (1), erhielt es vom Blutspendedienst des Schweizerischen Roten Kreuzes den Auftrag, entsprechende Verfahren zum Nachweis von HIV- bzw. HBV-Partikeln in Plasmapools zu entwickeln.
Das dabei vorgegebene Ziel ist es, in einem Pool von hundert Plasmakonserven eine Kontamination durch eine einzelne Konserve, die 5000 Genomkopien (DNA- oder RNA-Moleküle) pro Milliliter Plasma enthält, zuverlässig nachweisen zu können. Dies heisst, dass im Plasmapool eine Konzentration von lediglich 50 Genomkopien/ml nachgewiesen werden muss. Das ganze Verfahren soll zudem weitgehend automatisiert durchgeführt werden können und eine hohe Sicherheit aufweisen.
Was bedeutet dies konkret? Jedes Verfahren, das NAT verwendet, besteht aus mehreren Teilschritten. Im ersten Schritt muss die Nukleinsäure, DNA oder RNA, die es nachzuweisen gilt, aus dem Untersuchungsmaterial heraus extrahiert und von Hemmstoffen (Inhibitoren), welche den nachfolgenden Schritt behindern könnten, befreit werden. Im zweiten Schritt wird dann die gesuchte Virussequenz aus dem angereicherten Nukleinsäuregemisch selektiv vermehrt. In einem weiteren Schritt wird das Amplifikationsprodukt schliesslich analysiert und bestimmt, ob die gesuchte Erregersequenz da-rin enthalten ist.
Weil das Verfahren weitgehend automatisiert durchgeführt werden soll, wird für die Nukleinsäureextraktion ein Bioroboter verwendet, der gleichzeitig 96 Proben verarbeiten kann. Dieser Roboter kann aber nur Proben bis zu 200 µl Volumen verarbeiten. Da die Proben ja bereits aus 100 verschiedenen Plasmakonserven gepoolt sind, bedeutet dies, dass für den eigentlichen Vermehrungsschritt und Genomnachweis lediglich 2 µl des kontaminierten Plasmas zur Verfügung stehen, von den 5000 Genomkopien/ml also lediglich zehn Kopien.
Das vom NZR für den Genomnachweis ausgewählte NAT-Verfahren beruht auf der so genannten «TaqMan»-Technologie. Diese ist ein automatisiertes Amplifikationsverfahren auf der Basis der PCR (Polymerase Chain Reaction), bei welcher das Amplifikationsprodukt noch während seiner Entstehung in einem Echtzeitverfahren gemessen wird. Der zeitraubende zusätzliche Analyseschritt entfällt daher. Dieses Prinzip ist in Abbildung 1 illustriert.
Der von uns entwickelte TaqMan-HIV-Test ist in der Lage, all die verschiedenen Subtypen von HIV-1 mit einer analytischen Nachweisgrenze von unter zehn Viruskopien zu erfassen. Zusätzlich kann unser Test, im Gegensatz zu allen kommerziellen Verfahren, auch Viren der HIV-Gruppe O erkennen. In naher Zukunft wird auch die erst kürzlich von einer französischen Gruppe entdeckte neue HIV-1-Gruppe N erfasst werden können.
Der routinemässige Einsatz dieses Verfahrens im Blutspendewesen wird das schon heute äusserst geringe HIV-Infektionsrisiko nochmals weiter reduzieren. Da das Verfahren über einen breiten Konzentrationsbereich hinweg quantitativ ist, kann es ausser zum Screening auch zur Messung der Virusmenge bei HIV-positiven PatientInnen eingesetzt werden. Damit wird es möglich, den Infektionsverlauf, auch unter hochwirksamen antiretroviralen Therapien, empfindlicher, präziser, einfacher und kostengünstiger zu überwachen.
Ähnliche Verfahren zum hochsensitiven Nachweis der Hepatitisviren HBV und HCV befinden sich derzeit am NZR und im Zentrallabor des Blutspendedienstes SRK in Bern im Erprobungsstadium. Ein TaqMan-Verfahren wurde auch für den Nachweis von retroviraler reverser Transcriptase entwickelt (siehe Artikel Seite 20). Analoge Verfahren sind zudem für weitere Infektionserreger in Vorbereitung.
Literatur
(1) Cyril A. Shah: Entwicklung und Evaluation einer hochsensitiven molekularbiologischen Nachweismethode (Mega-PCR) für HIV-1 und andere Pathogene. Inaugural-Dissertation zur Erlangung der philosophischen Doktorwürde. Universität Zürich 1997.
Dr. Stefan Bosbach ist wissenschaftlicher Mitarbeiter und Dr. Jörg Schüpbach ist Titularprofessor für Virologie mit besonderer Berücksichtigung der Retroviren und Direktor des Nationalen Zentrums für Retroviren.
unipressedienst –
Pressestelle der Universität Zürich
Nicolas Jene (upd@zuv.unizh.ch)
Last update: 13.07.99