

In den vergangenen Jahren hat sich die Therapie der HIV-Infektion stark verändert. Die Entwicklung wirkungsvoller Kombinationstherapien hat ungeahnte Erfolge gebracht, und auch im Bereich des Therapiemonitorings ergeben sich neue Möglichkeiten.
Von Marek Fischer
Der Verlauf der HIV-Infektion und die Effizienz der Behandlung können heute auf verschiedenen Ebenen erfasst werden: Wichtigster klinischer Parameter ist das Auftreten von opportunistischen Infektionen oder Tumoren. Weiter widerspiegelt die Anzahl der Helfer-T-Lymphozyten (CD4-Lymphozyten) die Funktion des zellulären Immunsystems. Im Verlaufe der Krankheitsprogression werden die CD4-Lymphozyten zerstört. Schliesslich kann mit molekularbiologisch virologischen Methoden direkt die Menge und Aktivität des HI-Virus im Körper gemessen werden (Tabelle 1).
Bei erfolgreich behandelten PatientInnen treten in der Regel keine opportunistischen Erkrankungen mehr auf, die CD4-Lymphozyten können sich normalisieren und die Virusspiegel im Blut unter die Nachweisbarkeitsgrenze gesenkt werden. Die Vermehrung der Viren und deren negative Auswirkungen auf das Immunsystem scheinen damit bis zu einem gewissen Grad unter Kontrolle zu sein. Allerdings ist damit nicht bewiesen, dass die Virusvermehrung vollständig blockiert ist.
 |
|
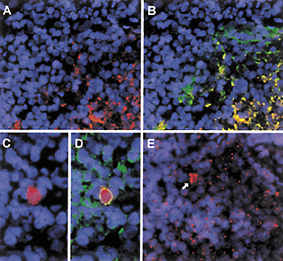
| Abbildung 1: Mikroskopischer Nachweis von HIV in lymphatischem Gewebe |
Zur Beurteilung des weiteren Therapieverlaufs ist deshalb eine kontinuierliche Weiterentwicklung von Messmethoden notwendig. Speziell interessiert, ob HIV in Zellen und verschiedenen Kompartimenten des Körpers – vor allem im Blut, Lymphgewebe, dem Nervensystem oder den Sexualorganen und deren Ausscheidungen – weiterhin aktiv repliziert.
Mittels molekularbiologischer Methoden, welche auf dem Prinzip der enzymatischen Amplifikation (Polymerase-Kettenreaktion, PCR) von Nukleinsäuren (DNS und RNS) basieren, können wenige Moleküle von HIV-RNS und -DNS in Proben von Zellen oder Flüssigkeiten nachgewiesen und quantifiziert werden. Zusätzlich ist es möglich, durch bildgebende histologische Techniken (Abb. 1) infizierte Zellen und Viren in Gewebeproben zu lokalisieren und speziellen Zelltypen zuzuordnen.
Solche Techniken liefern quantitative, aber auch qualitative Ergebnisse, welche wiederum mit den PCR-Messungen korreliert werden können. Durch die Bestimmung dieser verschiedenen Parameter in den verschiedenen Körper- und Gewebekompartimenten, welche unserer Beobachtung zugänglich sind, lässt sich ein differenziertes Bild des viralen Lebenszyklus entwerfen.
Intakte und defekte virale DNS
Die Menge von viraler DNS in einem bestimmten Zell- oder Gewebetyp stellt ein Mass für die Anzahl infizierter Zellen dar, da in der Regel nur ein HIV-DNS-Molekül pro infizierter Zelle beobachtet wird. Ein Teil der viralen DNS, welche im Blut und im Lymphgewebe nachgewiesen werden kann (Abb. 2A), repräsentiert allerdings nicht die vollständige Erbinformation, sondern mutmasslich defekte Teilstücke davon (Abb. 2B). Ausserdem kann, bedingt durch die grosse genetische Variabilität des HI-Virus, ein Teil der DNS (wie auch der daraus überschriebenen RNS) kleine Veränderungen der Erbinformationen tragen, sogenannte Punktmutationen, welche die Inaktivierung der betroffenen Genabschnitte, unter Umständen auch der gesamten genetischen Information, bewirken können.
Biologisch gesehen ist die virale DNS also nur zu einem Teil funktionstüchtig. Um funktionsfähige DNS spezifisch nachzuweisen, stehen zur Zeit nur aufwendige, wenig sensitive und nur in Ausnahmefällen angewandte Methoden zur Verfügung, mit welchen die Fähigkeit einer viralen DNS (oder einer infizierten Zelle) zur erfolgreichen Vermehrung über mehrere Lebenszyklen belegt werden kann.
Obwohl also nur ein Gemisch von funktionellen und defekten Molekülen nachgewiesen wird, ist die Quantifizierung viraler DNS wichtiger Teil einer vollständigen Analyse. Die Gegenwart von defekter viraler DNS als «Abfallprodukt» viraler Vermehrung ist ein zumindest indirekter Hinweis, dass im Körper noch aktiv HIV produziert werden.
Extra- und intrazelluläre virale RNS
Die virale RNS wird in den jeweiligen infizierten Zellen als Matrize für die Synthese von Eiweiss-körpern gebraucht. Diese Proteine werden zum Aufbau der Viruspartikel und zur Regulation der zellulären viralen Aktivitäten benötigt. Andererseits wird die HIV-RNS direkt in Viruspartikel verpackt und aus der Zelle ausgeschieden. Somit dient sie auch als genetischer Informationsspeicher für weitere Durchgänge des viralen Infektionszyklus. Extrazelluläre HIV-RNS repräsentiert also freie Viruspartikel, während die Menge an intrazellulärer HIV-RNS als eine Art Momentaufnahme der Aktivität von infizierten Zellen angesehen werden kann. Im Blut lässt sich mit technisch einfachen Mitteln zellfreies Plasma von den das Virus beherbergenden Zellen lymphoider Abstammung abtrennen. Die Menge extra- und intrazellulärer viraler RNS kann somit getrennt gemessen werden.
Bei Proben aus Lymphknoten und ähnlichen Geweben ist die Situation komplizierter. Einerseits findet man in diesem Gewebe, verglichen mit Blut, eine grössere Anzahl infizierter Zellen, welche je nach Stadium der Erkrankung, aber auch entsprechend dem jeweiligen Zelltyp oder dem Aktivierungszustand der betroffenen Zelle mehr oder weniger virale RNS, Proteine und auch Partikel bilden. Andererseits beobachtet man eine hohe Konzentration von extrazellulären HI-Viren, welche in spezialisierten Strukturen des lymphatischen Gewebes, den sogenannten Lymphknotenfollikeln, aufgefangen und festgehalten werden, ohne dass die betreffenden Zellen infiziert sind (Abb. 1). Diese so immobilisierten Viren dienen der körpereigenen Immunabwehr quasi als Steckbriefe zur Erkennung von HIV-Partikeln oder von infizierten Zellen, welche Virusbestandteile exprimieren.
Eine klinische Studie
In Zusammenarbeit mit anderen Schweizer Kliniken wird am Universitätsspital Zürich eine klinische Studie mit Freiwilligen durchgeführt, die seit einigen Monaten bis Jahren HIV-infiziert sind, aber noch keine Krankheitssymptome zeigen: Solche asymptomatischen Personen werden mit verschiedenen Kombinationen von antiretroviralen Medikamenten behandelt. Eine der Fragestellungen dieser Studie ist, ob eine frühe therapeutische Intervention den Ausbruch einer Immundefizienz verzögern oder gar verhindern kann.
Innerhalb einer kurzen Zeitspanne, zum Beispiel von zwei Jahren, ist die Beantwortung dieser Fragestellung durch das Beobachten des klinischen Verlaufs nicht möglich, da die Wahrscheinlichkeit gering ist, dass behandelte und unbehandelte Personen in diesem Zeitraum an Aids erkranken. Deshalb wird die Therapie mittels intensiver Beobachtung virologischer Parameter monitorisiert.
Das ausgewählte Beispiel (Abb. 3) zeigt einen im Ganzen gesehen als positiv zu beurteilenden Verlauf einer Therapie: Sowohl die Mengen von viraler DNS als auch von RNS zeigten einen raschen Abfall unmittelbar nach Einsetzen der Therapie. Wie anhand des Wiederanstieges des HIV-RNS-Spiegels im Plasma nach Studienwoche 4 zu erkennen ist (Abb. 3B), erwies sich dieser Effekt der Behandlung als nicht nachhaltig. Deshalb wurden ab Woche 24 die antiretroviralen Medikamente gewechselt und die Therapie intensiviert, was ein rasches und fast vollständiges Verschwinden der HIV-RNS im Plasma unter die Nachweisbarkeitsgrenze bewirkte.
Anhand dieses Parameters, welcher den für die Beurteilung gängigen Standard darstellt, hätte man auf eine vollständige Unterdrückung der viralen Replikation schliessen können. Die Auswertung der Messungen von HIV-RNS aus den zellulären Kompartimenten zeigte aber ein differenzierteres Bild: Im Gegensatz zu den RNS-Spiegeln im Plasma blieb die virale RNS in den Blutzellen und im Lymphgewebe über den ganzen Beobachtungszeitraum von zweieinhalb Jahren nachweisbar. Bei Proben aus der Studienwoche 96 wurde sogar eine deutliche Erhöhung gegenüber den jeweils vorangehenden Werten um eine Grössenordnung in den Blutzellen und zwei bis drei Grössenordnungen im Lymphgewebe beobachtet. Dies deutet darauf hin, dass das HI-Virus trotz der wirksamen Therapie im Körper immer noch aktiv ist und dass es sich, obgleich meist nur unterschwellig, weiterhin vermehren kann.
Die Mengen der viralen DNS im Blut und Lymphgewebe, welche hier nur während eines Jahres verfolgt wurden, zeigten nach Intensivierung der Behandlung keine Änderung.
Mit dem Vorbehalt, dass ein Teil dieser DNS, wie oben ausgeführt, möglicherweise defekt ist, bestätigt auch diese Beobachtung, dass trotz intensiver Therapie immer noch erhebliche Mengen von Virus im Körper des Patienten zirkulieren. Trotzdem sind diese bedeutend niedriger als ohne Therapie, womit auch der klinische Erfolg der Behandlung begründet ist.
Ausblick
Wie sich gezeigt hat, haben die in den letzten Jahren eingeführten Behandlungsmethoden der HIV-Infektion grosse therapeutische Fortschritte ermöglicht, welche auch eine substantielle Verminderung der Viruslast bewirken können. Das Ziel einer Heilung von HIV-Infektionen liegt aber immer noch im Bereich der Utopie, da im Körper von scheinbar effizient behandelten PatientInnen auch nach längerfristiger Behandlungsdauer noch beträchtliche Mengen von biologisch aktiven Viren beobachtet werden können.
Die Anwendung unserer hochsensitiven Nachweismethoden stellt vielleicht gerade wegen ihrer ernüchternden, aber realistischen Befunde eine Voraussetzung dar, um im Rahmen von zukünftigen Forschungsprojekten die Wirksamkeit neuer, möglicherweise verbesserter Behandlungsmethoden in verschiedenen Stadien der Krankheit zu charakterisieren.
Auch für den klinischen Alltag findet der Nachweis kleinster Mengen von viralen Nukleinsäuren eine wichtige Anwendung: Das Auftreten von resistenten HI-Viren, welche auf die in der Therapie verwendeten Medikamente nicht ansprechen, stellt ein wachsendes Problem dar. Die frühzeitige Erkennung von solchen Resistenzen durch den Nachweis von aktiver viraler Replikation und die Identifizierung der für die Resistenz kodierenden HIV-Gensequenzen wird deshalb ein immer wichtigerer Teil der virologischen Überwachung antiretroviraler Therapien.
Auf einer mehr zur Grundlagenforschung hin orientierten Ebene sind wir daran interessiert, die Beziehungen von Virus und Immunsystem zu definieren, um folgende Fragen zu beantworten: Wie und wo schädigt das Virus das Immunsystem? Wie schafft es andererseits das Immunsystem, das Virus über Jahre, bei manchen HIV-Infizierten gar Jahrzehnte, erfolgreich in Schach zu halten? In welchen Zellen überdauert das Virus die fortgesetzten Anfechtungen durch Immunsystem und Therapie?
Die in unserem Labor verwendeten Methoden der Analyse mittels In-situ-Hybridisierung und Immun-Histochemie ermöglichen es uns, infizierte Zellen von solchen, die das Virus dem Immunsystem präsentieren, ohne infiziert zu sein, zu unterscheiden, und deren Eigenschaften und möglicherweise auch deren Interaktion mit anderen Zellen bis auf die molekulare Ebene zu definieren. Kombiniert mit den sensitiven molekularbiologischen Methoden stehen uns damit wissenschaftliche Werkzeuge zur Verfügung, durch deren Anwendung wir zur Identifizierung und Entwicklung neuer therapeutischer Strategien beizutragen hoffen.
Dr. phil. II Marek Fischer ist Oberassistent an der Abteilung Infektionskrankheiten und Spitalhygiene des Universitätsspitals Zürich. KoautorInnen dieses Textes sind Herbert Kuster, Beda Joos, Marlyse Knuchel und Richard W. Cone, alle aus derselben Abteilung.
unipressedienst –
Pressestelle der Universität Zürich
Nicolas Jene (upd@zuv.unizh.ch)
Last update: 30.06.99