

In der molekularbiologischen Grundlagenforschung werden neue therapeutische Strategien gegen Aids bei Mensch und Tier gesucht. Dabei kommt dem Wissen über virale Eiweisse und Eiweisse in der Wirtszelle eine ganz zentrale Rolle zu.
Von Ulrich Hübscher
Die Kenntnisse der genauen Funktionsweise von Eiweissen von menschlichen und tierischen Zellen einerseits und der Immunschwäche-Viren andererseits geben Hinweise, wie das Virus die Wirtszelle «parasitiert». Dieses Wissen kann ganz neue Wege zu Therapieansätzen aufzeigen. Bis heute wissen wir jedoch sehr wenig über die Wechselwirkungen zwischen den viralen Eiweissen und denjenigen der Wirtszelle.
 |
|
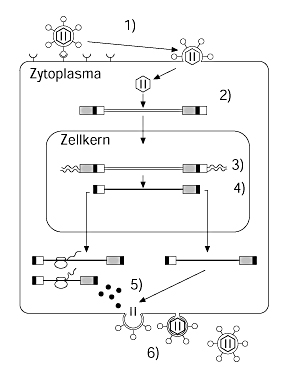
| Abbildung 1: Der Infektionsablauf der Lentiviren. |
Unsere Forschungsgruppe hat in letzter Zeit zwei virale Eiweisse aus dem menschlichen Immunschwäche-Virus (HIV) und dem felinen Immunschwäche-Virus (FIV) näher untersucht. Die Ergebnisse haben ergeben, dass die beiden wichtigen viralen Eiweisse, die Reverse Transkriptase (RT) und das Tat-Eiweiss, an gewisse zelluläre Eiweisse binden und somit deren Schaltfunktionen beinflussen können. Die zellulären Eiweisse sind Adaptoren für die Aktivität in der menschlichen Zelle und interagieren mit dem Tat-Eiweiss.
Der Infektionszyklus der Lentiviren
Im Jahre 1983 entdeckte Luc Montagnier am Pariser Pasteur-Institut bei einem Patienten mit chronischer Lymphknotenerkrankung ein bis dahin unbekanntes Retrovirus, das menschliche Immunschwäche-Virus Typ 1 (HIV-1), welches als Auslöser der schweren Immunschwächekrankheit Aids identifiziert wurde.
Die Retroviren unterteilt man in verschiedene Gruppen, wovon diejenige der Lentiviren im Zusammenhang mit Aids von besonderem Interesse ist. Man hat in den letzten Jahren erkannt, dass Lentiviren nicht nur beim Menschen (HIV-1, HIV-2), sondern auch bei verschiedensten Tierarten wie Affen (SIV), Katzen (FIV), Rindern (BIV), Pferden (EIAV), Schafen (Visna) und Ziegen (CAEV) vorkommen.
Obwohl diese Viren verschiedenartige Krankheitsbilder hervorrufen können, sind gewisse Strategien im Umgang mit den Wirtszellen sehr ähnlich. Die Lentiviren, wie alle Viren, sind obligate intrazelluläre Parasiten. Die Kenntnisse der Wechselspiele zwischen dem Virus und seiner Wirtszelle sind wichtige Voraussetzungen zum Verständnis des Krankheitsablaufes.
Folgende sechs Ereignisse sind entscheidend im Infektionzyklus der Lentiviren (Abb. 1):
Wir wissen, wie diese Vorgänge in groben Zügen ablaufen, sind jedoch noch weit davon entfernt, die Details der genannten Schritte zu verstehen.
Replikation und Regulation
Unsere Forschungsgruppe befasst sich nicht nur seit einigen Jahren mit dem Replikationsablauf vom HIV des Menschen und FIV der Katze, sondern auch seit neuerem mit der Regulation der genetischen Aktivität dieser Viren. Beide Projekte sollen hier kurz skizziert werden.
Die Retroviren zeichnen sich dadurch aus, dass sie eine besondere DNA-Polymerase, die Reverse Transkriptase, besitzen. Diese wird für die Reverse Transkription benötigt, die ein Teil der retroviralen Replikation darstellt. Sie beginnt, nachdem sich das Virus an die Zielzelle geheftet und das Virus-Kapsid ins Zytoplasma entlassen hat. Die virale Erbsubstanz, die als einzelsträngige Ribonukleinsäure (RNA) vorliegt, muss dabei in eine doppelsträngige Desoxyribonukleinsäure (DNA) umgeschrieben werden. Die doppelsträngige Virus-DNA wird sodann in den Zellkern transportiert, wo sie stabil mittels Virusenzymen ins Wirtsgenom eingebaut (und weitervererbt) wird.
Das virale Eiweiss, welches die Erbsubstanz des Virus in die DNA umschreibt, bezeichnet man als Reverse Transkriptase. Die Reverse Transkriptase des HIV-1 und FIV besteht aus zwei Polypeptid-Untereinheiten (p66 und p51). Beide Untereinheiten besitzen dieselbe Aminosäurenabfolge am N-terminalen Ende; der kleineren Untereinheit fehlt jedoch die RNase-H-Aktivität am C-Terminus, welche von der grossen Untereinheit durch die virale Protease abgespalten wurde. Obwohl die kleine Untereinheit (abgesehen von den 120 Aminosäuren am C-Terminus) dieselbe Aminosäuresequenz besitzt wie die grosse, unterscheiden sich die Strukturen der beiden Untereinheiten in der Röntgenstrukturanalyse stark. Vergleicht man nun die Sequenzen der HIV-1- und FIV-Reverse-Transkriptasen, so zeigt sich eine Identität von 48% und eine Ähnlichkeit von 67%.
Während den vergangenen sechs Jahren haben wir die Reversen Transkriptasen von HIV-1 und FIV genauer untersucht. Um die Reverse Transkriptase in grossen Mengen aus bakteriellen «Eiweissfabriken» isolieren zu können, wurde die FIV-RT in unserem Labor, die HIV-1-RT in den USA kloniert. Bakteriell produzierte Reverse Transkriptase ist identisch mit dem gereinigten Enzym aus Viren und kann gefahrlos in grossen Mengen gewonnen werden.
Dank gentechnologischer Methoden kann die Reverse Transkriptase sowohl als Heterodimer (p66/p51; natürliche Form) wie auch als Homodimere (p66/p66 oder p51/p51) gewonnen werden – RTs von HIV und FIV dimerisieren, sobald sie in homologer Form vorliegen. Im Rahmen von zwei Dissertationsarbeiten gelang es, sogenannte Mischenzyme zwischen HIV-1 und FIV herzustellen. Man bezeichnet sie als Chimären. Die HIV/FIV-Chimären haben gezeigt, dass die Enzyme des HIV und FIV ähnlich sind. Geringfügige Unterschiede in Struktur und Funktion machten deutlich, wie diese äusserst wichtigen Enzyme während der Virusreplikation arbeiten.
Alle bisher erfolgreichen Medikamente gegen Aids beruhen auf einer Hemmung der Reversen Transkriptase (zum Beispiel AZT und DDI).
Regulation der genetischen Aktivität der Lentiviren
Nachdem das Virus sein repliziertes genetisches Material in dasjenige der Wirtszelle eingebaut hat, ist es auf die Aktivierung seiner eigenen Gene durch die Wirtszelle angewiesen. Das HIV besitzt unter anderem ein Gen, welches für das Tat-Eiweiss kodiert. Wird Tat in der infizierten Wirtszelle hergestellt, aktiviert es ganz spezifisch die Gene des in der Wirtszelle eingeschleusten HIV. Für eine optimale Aktivierung der HIV-Gene ist Tat jedoch auf andere Eiweisse der Wirtszelle angewiesen (HIV ist wie erwähnt ein Parasit). Bis heute wurden schon etliche Eiweisse, die Tat für seine Funktion «missbraucht», identifiziert.
Kürzlich wurden zwei Eiweisse gefunden – p300 und CBP –, die eine wichtige Rolle bei der Aktivierung von zellulären Genen spielen. Sie wirken im Zellkern und interagieren mit einer Vielzahl von Eiweissen, die für die Aktivierung von zellulären Genen verantwortlich sind. p300 und CBP funktionieren als sogenannte Adaptoren von Signalen aus dem Umfeld der Wirtszelle (zum Beispiel Wachstum oder Entwicklung) oder aus der Wirtszelle selber (zum Beispiel Stress).
Eine wichtige Aktivität von p300/CBP ist ihre Fähigkeit, Verpackungseiweisse der DNA – man bezeichntet sie als Histone – zu modifizieren. Durch diese Modifikation wird die Verpackung etwas gelockert und ermöglicht zusätzlichen Eiweissen den DNA-Strang zu kontaktieren und die Aktivierung der Gene zu beeinflussen. Das HI-Virus «missbraucht» nun diese beiden Eiweisse, um für sich selber ein optimales Umfeld zu schaffen.
Wir konnten nachweisen, dass das Tat-Eiweiss des HIV mit p300 und CBP interagiert und letztere somit auch eine wichtige Rolle in der Genaktivierung des HIV selber spielt. Die Interaktion wurde mittels verschiedener Methoden nachgewiesen und hat unser Verständnis vor allem bezüglich der Funktion von Tat innerhalb der Wirtszelle erweitert. Tat scheint durch die Adaptoren p300 und CBP auch mit Eiweissen, die in einer anderen zeitlichen Phase der Genaktivierung beteiligt sind, Kontakt aufnehmen zu können.
Das molekularbiologische und biochemische Studium von Viren, welches dank der Unterstützung des Nationalen Aids-Forschungsprogrammes möglich ist, hat also einen doppelten Nutzen: Wir lernen mehr über den Virus/Wirtszellmechanismus, und wir haben die Möglichkeit, neue therapeutische Strategien zu entwickeln, die für HIV dringend notwendig sind, wenn man in Betracht zieht, dass weltweit mehrere Dutzend Millionen Menschen von dieser Krankheit betroffen sind und ohne neue Therapiemöglichkeiten in einigen Jahren werden sterben müssen.
Dr. Ulrich Hübscher ist Ordinarius für Veterinärbiochemie und Direktor des Instituts für Veterinärbiochemie. Koautoren dieses Artikels sind Taurai Tasara, Sameez Hasan und Michael Hottiger.
unipressedienst –
Pressestelle der Universität Zürich
Nicolas Jene (upd@zuv.unizh.ch)
Last update: 30.06.99